“إنها مفارقة لا تصدق، فنحن بحاجة إلى النيتروجين للبقاء، وفي الوقت الذي نسبح في بحر منه لا نستطيع الوصول إليه مباشرة. وبدلاً من ذلك، يحصل الإنسان والحيوان على هذا المركَّب من البروتين في الغذاء، أما النباتات فتحصل عليه من التربة”، يقول أنسي سيفيلد، عالم الكيمياء الحيوية في جامعة يوتا الأمريكية. لكن العلـم يفتـح اليوم نافذة على عالــم النيتروجيــن، تبــدو مثيرة لاهتمام المعنيين بشؤون الطاقة بشكل خاص.
الكل يعلم أن حالة الرفاهية والبحبوحة التي يعيشها معظم سكان العالم اليوم، سببها التقدُّم العلمي والتكنولوجي، ولكن القليل يعلم أن جـزءاً مهمـاً في هذا المجـال يعود إلى كيمياء تفكيك روابط النيتروجين، كما سنرى لاحقاً. والحفاظ على هذه الرفاهية ربما سيعتمد مرة أخرى، في المستقبل، على هذه الكيمياء.

ما هو النيتروجين؟
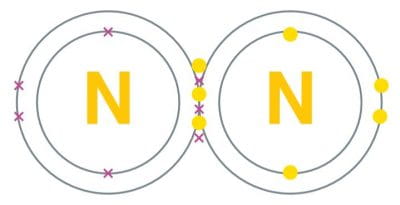
النيتروجين عنصر كيميائي رمزه الحرف (N)، ويكون في الشروط العادية من الضغط الجوي ودرجة الحرارة على شكل N2 أي ذرتين منه مندمجتين برابطة ثلاثية هي من أقوى الروابط المعروفة، ليصبح على شكل غازٍ عديم اللون والطعم والرائحة وغير سام.
ويشكِّل النيتروجين %78 من الغلاف الجوي للأرض على شكل دي نيتروجين، والحياة بكل أشكالها الإنسانية والحيوانية والنباتية تحتاج إلى النيتروجين. فهو يدخل في تركيب جميع الأنسجة الحية؛ إنه عنصر حيوي في الأحماض الأمينية، وبالتالي البروتينات، وكذلك في الأحماض النووية: الحمض النووي الريبوزي منقوص الأوكسجين والحمض النووي الريبوزي.
ويدخل النيتروجين أيضاً في تركيبة معظم أنواع الطاقة التي استخدمها الإنسان منذ اكتشافه النار، فهو مكوّن أساسي في الحطب والفحم الحجري وبقية أنواع الطاقة الأحفورية. وبالتالي فإن النيتروجين يلعب دوراً مهماً في تقدُّم الحضارة الإنسانية.
ويعتقد العلماء أن النيتروجين عنصر شائع أيضاً في الكون. إذ يُقدر ترتيبه السابع من حيث وفرة العناصر الكيميائية في مجرتنا درب التبانة. كما يعتقدون أنه ناتج عن الانصهار النجمي من عنصري الهيدروجين والكربون في السوبرنوفا.
دورة النيتروجين
تقوم الطبيعة بالعملية نفسها التي بدأ العلماء بالسعي في التوصل إليها لإنتاج الطاقة وغيرها، وهي تثبيت النيتروجين وفك روابطه وتحويله من غازٍ لا فائدة منه بشكله N2 المتوفر بكثرة، إلى عنصرٍ قابلٍ للاتحاد مع عناصر أخرى. وتتم هذه العملية الطبيعية عبر دوران النيتروجين بين الجو والتربة والماء ونباتات الأرض وحيواناتها. وهكذا يدخل النيتروجين في تركيبة العديد من العناصر الكيميائية الأخرى خاصة العناصر العضوية. وبذلك تستطيع النباتات امتصاص النيترات أو الأمونيا من التربة بواسطة شعيرات جذورها. وعند امتصاصها، يتحوَّل جزء من النترات إلى أيونات النتريت ومن ثم إلى أيونات الأمونيوم لتندمج بالأحماض الأمينية والأحماض النووية التي تعود النباتات وتوفرها بدورها إلى البكتريا في عملية تكافلية مستمرة.
وعندما تموت النباتات والحيوانات، تتعرَّض للتحلل بواسطة بكتيريا وفطريات معينة. فينتج عن ذلك مادة النشادر NH3، وهي من مركبات النيتروجين في المادة العضوية الميتة وفي مخلفات الأجسام التي تفرزها الحيوانات. ثم تمتص النباتات بعض النشادر وتستخدمه لصنع البروتينات والمواد الأخرى الضرورية للحياة من جديد، وبعضها الآخر يتبدَّد في الهواء، وهكذا دواليك.
محاولات تحويل سابقة
انصبت جهود العلماء منذ القرن التاسـع عشر على ما يعرف علمياً بـ “تثبيت النيتروجين” بطريقةٍ اصطناعية. وهي عملية يتم بواسطتها تحويل النيتروجين في الجو N2 إلى أمونيا، أو أية جزيئات أخرى ضرورية للأعضاء الحية، وكذلك لتحويل الطاقة الكيميائية في روابط النيتروجين إلى كهرباء. ويتمحور هذا التثبيت حول فك الرابطة الثلاثية التي تجمع ذرتي النيتروجين. وهذه عملية صعبة جداً لأن هذه الرابطة قوية بسبب تفاعل عناصرها الثلاثة وتشاركها الإلكترونات، وأيضاً لأن هذا الغاز خامل ولا يتفاعل مع عناصر أخرى كي يتحوَّل.
تُوِّجت هذه الجهود عند بداية القرن العشرين بتمكن علماء ألمان من تفكيك هذه الرابطة، ولكن باستعمال كثير من الطاقة الأحفورية. وهذا ما تحاول الأبحاث الجديدة الواعدة تجنبه، والتوصل إلى وسائل مبتكرة دون تكلفة كبيرة، وتكون في الوقت نفسه صديقةً للبيئة.
ففي عام 1909م، تمكَّن العالمان الألمانيان فرانز هابر وكارل بوش، بواسطة عملية كيميائية عبقرية من كسر روابط النيتروجين القوية. وفتح ذلك الاكتشاف الفذ المجال واسعاً لعمليات صناعية رائدة. حيث تم بواسطتها إنتاج الأمونيا من النيتروجين والهيدروجين على نطاقٍ عالمي، الأمر الذي أدَّى بدوره إلى إنتاج الأسمدة على نطاقٍ تجاريٍ واسعٍ. فأطلق هذا التطور العلمي حركة نموٍ غير مسبوقةٍ للإمدادات الغذائية العالمية، وقضى على كثيرٍ من حالات المجاعة التي كانت تتكرَّر كل فترةٍ زمنية.
وتأكيداً على هذه الحقيقة، يعتقد العلماء، أن حوالي %50 من ذرات النيتروجين في جسم كل فردٍ على وجه الأرض اليوم، مصدرها هذه العملية الصناعية بحد ذاتها.
تقوم هذه العملية على تحويل النيتروجين الجوي N2 إلى أمونيا NH3 عن طريق تفاعل مع الهيدروجين H2 الذي يتم استخراجه من الغاز الطبيعي على شكل ميثان، مستخدمين معدن كمحفز تحت درجات حرارة عالية وضغط جوي مرتفعٍ جداً.
ولكن بالرغم من المنفعة الكبيرة التي استفاد منها معظم سكان الكرة الأرضية، تتطلـب هذه العملية طاقة كبيرة ورأس مال كبير. مما يؤثر على البيئـة، وبالتالـي تُعـدُّ غيـر مجدية لتطبيقها على إنتاج الطاقة.
الجهود الحالية
الدعوات المتزايدة والمُلِحَّة لتحسين كفاءة الطاقة بعمليات أصغر حجماً وأكثر مرونة وأفضل بيئياً تُحفِّز قوة دفعٍ كبيرة لتوسيع نطاق كيمياء النيتروجين. ويتلخص التحدي الكبير في هذا المجال، بتطوير المحفزات والعمليات التي توفر طرقاً بسيطة قليلة الاستهلاك للطاقة وتكسر روابط هذا العنصر الكيميائي.
والحال أن جهود علماء كيمياء النيتروجين استراحت لأكثر من قرن بعد الاكتشاف التاريخي الكبير الذي حققه هابر وبوش، تقدَّمت خلالها كيمياء الكربون والتكنولوجيا المرتبطة بها إلى مركز الصدارة. مما أدَّى إلى اكتشافات رائعة تمثلت بإنتاج مجموعة واسعة من المنتجات بما في ذلك البلاستيك والمستحضرات الصيدلانيـة وغيرها الكثير. وفي المقابل، لم يتغيَّر شيء يذكر في كيمياء النيتروجين الصناعية.
يعكس هذا الواقع في جهة منه، الأهمية القصوى والكفاءة المتأصلة في عملية “هابر – بوش” وأثرها العميق على الباحثين. ويعكس من الجهة الأخرى التحدي الخاص المتمثل في كسر رابطة الدي نتروجين القوية. ليستفيق العلماء في السنوات الثلاث الماضية على ما يشبه حمى أبحاث النيتروجين؛ وكأن سباقاً قد فاتهم من قبل، وها هم قد بدأوا به للتو. فقد أدركوا أن هناك إمكانية كبيرة كامنة بين ظهرانيهم لم يولوها الاهتمام الذي تستحقه. فتسارعت في الآونة الأخيرة الأبحاث الجماعية والاختبارات من الصين إلى الولايات المتحدة لبحث إمكانية استخراج الطاقة من النيتروجين وإحداث نقلة نوعية على هذا الصعيد.
تجارب صينية ناجحة على البطاريات
في عالم يعتمد بشكل متزايد على الكهرباء، وتنصب الجهود على الانتقال من الموارد المحدودة إلى عالم كهربائيٍ مستدام، أصبح تطوير البطاريات والتكنولوجيا المتعلقة بها أمراً حيوياً.
وعلى الرغم من وجود عديد من التطورات الحديثة في تكنولوجيا البطاريات، إلا أن بطاريات الليثيوم أيون لا تزال هي الأكثر شيوعاً بسبب كفاءتها من حيث التكلفــة، غير أنها ليست مستدامـة. ولذا لا يزال العلماء يبحثون عن حلٍ تنافسي ورخيص ومستدام. وهذا ما فعله فريق من معهد تشانغتشون للكيمياء التطبيقية في الصين مع النيتروجين، ونشر نتيجة اختباراته الناجحة في مجلة “سيل بريس” البريطانية.
قام هؤلاء الباحثون بتطوير بطارية ليثيوم نيتروجين Li-N2 قابلة لإعادة الشحن. ويحتوي هذا النظام على قطب كهربائي موجب (Li)، ومحلول كهربائي، وقطب كهربائي سالب. وقد أظهر هذا النموذج “كفاءة فارادية” كيميائية واعدة بلغت %59 (قدرة شحنة الإلكترونيات للتحوُّل إلى تفاعل كهروكيميائي)
وبخلاف بطاريات الليثيوم التقليدية التي تقوم على توليد الطاقة من خلال تفكيك نيتريد الليثيوم إلى الليثيوم وغاز النيتروجين بطريقة مشابهة ل “هابر – بوش” التقليدية، يعمل النموذج الأولي لبطارية (Li-N2) الذي تم تطويره في معهد تشانغتشون، على النيتروجين الجوي في الظروف المحيطة ويتفاعل مع الليثيوم لتكوين نتريد الليثيوم، الذي يمثل طريقةً فعالةً أكثر بكثير من تحويل النيتروجين لإنتاج الطاقة.
محاكاة الأنزيمات الحية في تحويل النيتروجين
ونشرت مجلة “ساينس” في عددها لشهر مايو 2018م، دراسة واسعة شارك فيها 14عالماً كيميائياً، حول كيمياء النيتروجين شبيهة بتلك التي تقوم بها الأنزيمات في الطبيعة، والآفاق الكبيرة التي تعد بفتحها في ما يتعلق بتحويل النيتروجين.
والحال إن الميكروبات التي تعيش في جميع النظم البيئية الرئيسة قادرةٌ على تحويل (N2) إلى (NH3) باستخدام إنزيم النيتروجينيز. ويمكن أن يؤدي الفهم الأعمق لهذا الإنزيم إلى محفزاتٍ أفأ في تحويل النيتروجين ضمن الظروف المحيطة، ودون الحاجة إلى استخدام طاقة إضافية لتوفير ظروف أخرى ملائمة كما هو معمول به حالياً. وقد تم تصميم نموذجٍ لمحفزات جزيئية تحاكي بعض الوظائف النشيطة التي يقوم بها النيتروجينيز. كما تم تحقيق بعض النجاح المتواضع في تصميم محفزات كهربائية لتحويل الدي نتروجين بطريقة مشابهة لهذا الأنزيم. فالكيمياء الكهربائية تتجنب النفقات والأضرار البيئية لإنتاج غاز الميثان، وبالتالي الأمونيا، التي تنطوي عليها معظم تكاليف عملية “هابر – بوش”.
النيتروجين يمتلك مفتاح الاستدامة
وكان مكتب وزارة الطاقة الأمريكية لعلوم الطاقة الأساسية قد عقد اجتماعاً مع أنسي سيفيلد، عالم البيوكيمياء في جامعة يوتا الأمريكية وستة عشر خبيراً آخرين في أبحاث النيتروجين في واشنطن العاصمة، ونسَّقوا الجهود للقمة التي عقدت في أكتوبر 2016م لمناقشة المجال الحالي لكيمياء تفعيل النيتروجين واتجاهاته المستقبلية. ووجدوا، في ختام هذا المؤتمر المهم، أنهم أمام باب واسعٍ جداً يمكن أن يوفِّر مصدراً إضافياً للطاقة: فالنيتروجين يمتلك مفتاح الاستدامة بما يتجاوز كل أشكال الطاقة المتجدِّدة المعروفة. ونشر الفريق مراجعة لاستنتاجاته المهمة في مجلة ساينس في عدد 25 مايو 2018م.
في عام 1909م، تمكَّن العالمان الألمانيان فرانز هابر وكارل بوش، بواسطة عملية كيميائية عبقرية من كسر روابط النيتروجين القوية. وفتح ذلك الاكتشاف الفذ المجال واسعاً لعمليات صناعية رائدة.
وتأكيداً على أهمية هذه الأبحاث والآمال المعلّقة عليها قال سيفيلد: “هذا التجمع هو بمثابة “Who’s Who” (أي الأسماء الشهيرة) في أبحاث النيتروجين. إن مجموعتنا تضم روبرت شروك الحائز جائزة نوبل، ونظراً للجهود الكبيرة التي بُذلت، اعتُبر هذا الاجتمـاع إثباتــاً للقـوة. لم يكن أحـد منـا قادراً أن يكتب منفرداً هذا التقرير”.
وأضاف: “هناك فرصة متاحة لتحقيق مسارات جديدة ومختلفة بشكل جذري في مجال الطاقة. لكن التقدّم في هذا الصدد سيتطلب فهماً إضافياً لتفاعلات تحويل النيتروجين على مستوى الجزيئات، فضلاً عن أن اكتشاف أنظمة محفزة جديدة ووسائل بديلة لتوفير الطاقة اللازمة لدفع هذه التفاعلات”.
وتعليقاً على أهمية إيجاد بديل لـ “عملية هابر – بوش” قال: “لقد كانت واحدة من معجزات التاريخ التكنولوجية، لكنها تستهلك حالياً حوالي %2 من إمدادات الوقود الأحفوري في العالم، وبالتالي، فهي تترك بصمة كربون ثقيلة جداً”.
والعامل المشجِّع في هذا الصدد، هو أن سيفيلد وفريقه من جامعة يوتا، قاموا بعمل رائد سابقاً، على صلة بهذا الموضوع، تمثل بقيامهم بعملية نظيفة ومتجددة بتحويل النيتروجين إلى أمونيا، العنصر الأساسي في الأسمدة، باستخدام تكنولوجيا ضوئية.
واستخدام الفريق مواد نانوية في سبيل التقاط الطاقة الضوئية عند تحويل النيتروجين إلى أمونيا، يوضح كيف يمكن لضوء الشمس أو الضوء الاصطناعي أن يثبِّت استقرار النيتروجين؛ وهذا بحد ذاته إنجاز كبير جداً يبشر بعصر جديد مقبل.
ختاماً، وبدلاً من استخدام طاقةٍ كبيرةٍ لكسر روابط النيتروجين القوية جداً كما هو سائد الآن، يحاول العلماء الآن كسر هذه الروابط بطرق مبتكرة لإنتاج طاقة هائلة. ويبدو أنهم قد خطوا الخطوة الأولى في مسيرة الألف ميل.